Актуальной проблемой стоматологии являются заболевания височно-нижнечелюстного сустава (ВНЧС). В 70-80% случаев заболевание ВНЧС является функциональным нарушением. Особое место среди подобного рода заболеваний занимает синдром болевой дисфункции (СБД) височно-нижнечелюстного сустава. Изучению причинных факторов патогенеза, диагностике и лечению данной патологии посвящены многочисленные публикации в отечественной и зарубежной литературе. В настоящее время является общепризнанной концепция важной роли центральной нервной системы в формировании патогенетических и клинических детерминант данного заболевания. Недооценка данного фактора может привести не только к узкой трактовке патогенеза данного заболевания, но и явиться фактором мешающим оценить наличие сопутствующих расстройств, влияющих на исход заболевания. Особенно это относится к депрессивным расстройствам. [1;4;6]
Аффективные расстройства депрессивного спектра – наиболее частая форма психической патологии у пациентов, обращающихся за помощью в общемедицинские учреждения. По данным разных авторов доля гипотимических расстройств у больных этого контингента составляет от 10% до 33%. В экономически развитых странах частота депрессивных состояний у больных соматического стационара, обратившихся за консультативной психиатрической помощью составляет 18-28%. [9; 10] По данным Смулевича А.Б. (1999) сплошное клинико-эпидемиологическое обследование пациентов территориальной поликлиники выявило депрессивные расстройства в 21,5% случаев, а у пациентов крупной многопрофильной больницы в 20,5%. Депрессии ухудшают течение соматического заболевания и вместе с тем, усложняя клиническую картину, ведут к повышению частоты обращений за медицинской помощью. Они могут провоцировать соматическое заболевание и быть реакцией на него, но во всех случаях депрессия отягощает течение основного заболевания. Следует отметить, что своевременная диагностика и патогенетически обоснованная терапия гипотимических расстройств является зачастую необходимым фактором оказания полноценной, комплексной медицинской помощи. Однако недостаточная осведомленность врачей общей практики о клинике и диагностике аффективных расстройств приводит к тому, что лишь в 10-50% устанавливается правильный диагноз. [6]
Необходимо различать соматизированные и соматогенные депрессии. Последние, как правило, возникают при тяжелом хроническом течении многих соматических заболеваний. Гипотимические расстройства часто встречаются, например, при таких заболеваниях как: сахарный диабет, тиреотоксикоз, ишемическая болезнь сердца, язвенная болезнь желудка и двенадцатиперстной кишки, гепатиты, циррозы, ревматоидный артрит, рак, СПИД, миома матки, глаукома. Симптоматические депрессии формируются в тесной зависимости от динамики соматической патологии: проявления аффективных расстройств манифестируют при нарастании тяжести и редуцируются по мере обратного развития симптомов соматического заболевания. Получены статистически достоверные подтверждения неблагоприятного влияния депрессий различного генеза на адаптацию соматических больных. Доля инвалидов I и II группы по соматическому заболеванию при коморбидной депрессии значимо превышает соответствующий показатель для изученной выборки в целом. [6] Терапия депрессий у соматических больных сопряжена с серьезными затруднениями в связи с ограниченностью сведений о соматотропных эффектах психофармакологических препаратов последних поколений. При изучении этих медикаментов из исследования, как правило, исключаются лица с патологией внутренних органов. Ведущим методом лечения депрессий является психофармакотерапия. [2;3;5] Основное место в арсенале лечебных воздействий принадлежит антидепреcсантам.
В последнее время наблюдается значительный прогресс в области изучения механизмов действия антидепрессантов и патогенеза депрессий. В частности, определена сравнительная сила влияния отдельных препаратов на пресинаптический захват того или иного нейромедиатора или блокирующего влияния на тот или иной тип рецепторов. Это позволило, с одной стороны, синтезировать препараты с заданными клиническими свойствами, а с другой, значительно повысить их физиологическую переносимость и избежать нежелательных лекарственных взаимодействий. Новое поколение антидепрессантов – селективных ингибиторов обратного захвата серотонина стало обладать большей быстротой и избирательностью действия и более высокой безопасностью применения (отсутствие сердечно-сосудистых и холинолитических побочных явлений). Появление препаратов с высокой селективностью действия на ту или иную нейромедиаторную систему, на тот или иной вид пре- или постсинаптических рецепторов, тот или иной разрушающий нейромедиатор фермент, позволило достаточно точно прогнозировать определенные клинические эффекты применяемых лекарств и использовать их более целенаправленно и рационально. Так как профиль фармакодинамической активности во многом определяет и индивидуальный спектр их психотропного, нейротропного и соматотропного действия, которым нужно руководствоваться при выборе того или иного антидепрессанта для конкретного больного. [2;3]
В настоящее время эффективность и экономичность разных методов лечения целесообразно оценивать не только по широко применяющимся критериям, но и по специальным показателям качества жизни. Оценка качества жизни – новое и перспективное направление медицины, которое дает возможность точнее оценивать нарушения в состоянии здоровья пациентов, яснее представлять суть клинической проблемы, определить наиболее рациональный метод лечения, а также оценить его ожидаемые результаты по параметрам, которые находятся на стыке научного подхода специалистов и субъективной точки зрения пациента. Традиционная оценка результатов лечения не дает возможности определить влияние на качество жизни пациента. В результате этого возникшее нарушение соответствия в оценке эффективности лечения, даваемой врачом и пациентом, отдаляет врача от больного и содержит опасность нерационального использования мощного арсенала современной медицинской помощи. Возникший диссонанс объясняется в первую очередь тем, что, оценивая эффективность лечебных мероприятий, медики в основном акцентируются на физиологических изменениях в организме, а пациенты на изменениях состояния организма под воздействием психологических и социальных факторов окружающей среды. Таким образом, в настоящее время эффективность и экономичность различных методов лечения целесообразно оценивать и по показателям качества жизни, входящим в специальные методики. При тестировании качества жизни основное внимание уделяют оценке индивидуального восприятия своих функциональных возможностей. Использование подобных методик необходимо, так как многие нюансы, оказывающие существенное влияние на самочувствие пациента вне подхода, позволяющего оценить качество жизни, ускользают от внимания исследователя.
Для изучения параметров качества жизни мы использовали Nottingham Health Profile (NHP), визуально-аналоговую шкалу самооценки самочувствия (ВАШ) и методику оценки качества жизни при суставной патологии (МОКС). Из представленных методик одна является общей, а другие частными. Использование данной комбинации было продиктовано следующими соображениями. Сравнительная оценка глобальной эффективности того или иного воздействия по предлагаемым функциональным параметрам невозможна без общей методики. В то время как для того, чтобы более детально охарактеризовать проведенное исследование, ограниченное определенными узкими нозологическими рамками, необходимо наличие специального опросника для оценки более узких аспектов качества жизни, определяемых характером проводимого исследования по изучаемой патологии. Визуально-аналоговые шкалы (ВАШ) представляли собой десятисантиметровые отрезки прямой, левая крайняя точка которых соответствовала наилучшей самооценке, правая – наихудшей. В дальнейшем выраженность этих параметров измеряли в сантиметрах, и эти показатели подвергали статистической обработке. Шкала (NHP) валидна, надежна и чувствительна. Она представляет анкету, состоящую из двух частей. Каждому предполагаемому ответу первой части методики присвоены балльные значения, представляющие взвешенную величину, вычисленную в большом популяционном исследовании. Их сумма равна 100, что соответствует наихудшему уровню качества жизни по данному параметру. В соответствии с целями нашей работы мы исключили из NHP раздел, актуальный при обследовании больных с сердечно-сосудистой патологией. Вторая часть методики служит для оценки явления состояния здоровья на основные виды повседневной деятельности пациента и нами не использовалась. Анкета (NHP) не включает интегрированного показателя качества жизни. Интегральную оценку мы регистрировали при помощи (ВАШ) и (МОКС). Всего было обследовано 68 больных с синдромом болевой дисфункции ВНЧС. Данная группа больных делилась на две подгруппы В и С. в данных подгруппах а качестве базисного лечения применялась стандартная, патогенетическая, комплексная терапия ВНЧС. У пациентов группы С в качестве лечебного фактора также применялась и психотерапия. У наблюдаемых подгруппы В она была дополнена селективными серотонин-позитивными антидепрессантами. Контрольную группу составили 38 здоровых людей. Для диагностики депрессивных состояний у больных СБД ВНЧС и анализа динамики симптомов заболевания в процессе проводимого лечения нами применялись психометрические оценочные (рейтинговые) шкалы. Последние являются инструментом регистрации наблюдаемых признаков, соответствующим современным требованиям – максимальной информативности, надежности, воспроизводимости, а также доступности и краткости при достаточно дифференцированных количественных градациях. В современной психиатрии применение психометрических методик является не только неотъемлемой частью научных исследований, но и одним из эффективных подходов к решению ряда насущных проблем клинической практики. В деятельности учреждений общей медицины стандартизованная регистрация наблюдаемых на клиническом уровне психопатологических проявлений обеспечивает раннее выявление больных с депрессивными расстройствами, а также оценку динамики состояния в процессе терапии. Нами использовались следующие шкалы: госпитальная шкала тревоги и депрессии (HADS); шкала Цунга для самооценки депрессии (SDS) шкала Гамильтона (HDRS); шкала Монтгомери-Асберг (MADRS). Для диагностики депрессивных состояний использовались операциональные диагностические критерии рубрики "Аффективные расстройства настроения" (F3) десятого пересмотра международной классификации болезней (МКБ - 10, 1994). Следует подчеркнуть, что сформированные группы были статистически однородны по ряду важнейших признаков, в том числе таким как социальное положение и демографические показатели. Последнее особенно важно, так как позволило предположить, что наблюдаемые могли бы иметь одинаковые показатели качества жизни в отсутствии указанных заболеваний. Данные, полученные при обследовании больных, обработаны с помощью методов вариационной статистики, позволяющей вычислить необходимые параметры для определения достоверной значимости результатов исследования. В каждой из групп для всех признаков вычислялись средняя арифметическая (М), средняя ошибка средней арифметической (m), коэффициент достоверности существенной разницы (t) и вероятность ошибки (p). Возможность применения параметрического метода статистического анализа (критерий Стьюдента) была обоснована наличием нормального (Гаусовского) распределения массива данных в изучаемых выборках. Это указывало на малое влияние изучаемых переменных на исследуемый процесс. Математическая обработка результатов исследования проводилась с помощью пакета прикладных программ SPSS и "Statistica for Windows" на персональном компьютере IBM Pentium.
По изучаемым методикам (ВАШ) и (NHP) наблюдаемые группы характеризовались следующими показателями, отраженными в табл.1.

Таблица 1. Показатели качества жизни по ВАШ и NHP в исследуемых группах
Таким образом, у больных СБД ВНЧС, составляющих группу В наблюдались значительно более плохие показатели качества жизни. Достоверных различий не было выявлено только по параметру социальная изоляция. По параметрам эмоциональные реакции и сон статистическая значимость различий составляла (р<0,05). По остальным параметрам (р<0,001). Самооценка самочувствия, регистрируемая по ВАШ также достоверно отличалась (р<0,001) в исследуемых группах.
Оценка качества жизни больных СБД ВНЧС, проведённая по разработанному нами опроснику (МОКС) характеризовалась значительно худшими показателями по сравнению со здоровыми контрольной группы. Достоверные различия наблюдать по всем изучаемым параметрам. По шкалам активность и перспективы состояния здоровья статистическая значимость различий составляла (р<0,05), а по всем остальным (р<0,001).

Таблица 2. Показатели качества жизни по МОКС в исследуемых группах
Применение методики оценки качества жизни в качестве критерия эффективности проводимой комплексной тимоаналептической терапии позволило сделать следующие наблюдения. У пациентов группы В по всем изучаемым параметрам на 30 сутки наблюдения изменения в сторону улучшения показателей. Причём по всем пунктам кроме одного статистическая значимость происходящих изменений составила (р<0,001). Исключения составил раздел "перспективы состояния здоровья" - (р<0,05). У наблюдаемых группы С только по двум параметрам наблюдались достоверные различия, по остальным отмечалась только тенденция к улучшению показателя не получившая статистической значимости. В разделах оценивающих основные симптомы заболевания и болевые реакции при движении в суставе достоверность изменений показателей составила (р<0,05). Если в начале проводимого контроля в обеих группах показатели статистически не отличались (р>0,05) между собой, то в конце проводимого лечения были достоверны не равнозначны (р<0,001). Причём интегральный показатель у пациентов группы В был лучше почти в 2 раза (р<0,001). Данные отражены в таблице 3.
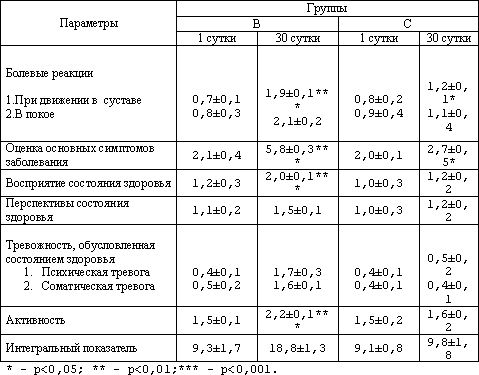
Таблица 3. Динамика показателей качества жизни в зависимости от вида тимоаналептической терапии (шкала МОКС)
Анализ редукции депрессивной симптоматики в зависимости от вида темоаналептической терапии характеризовался следующими наблюдениями. Первые сутки позволили сделать вывод о наличии гипотимии в обеих группах В и С по всем применяемым рейтинговым шкалам. Причём достоверных различий в обеих группах по изучаемым показателям в пределах одной оценочной методики не наблюдалось. Как правило регистрировалось депрессивное расстройство средней степени выраженности. Однако в дальнейшем динамика изучаемой симптоматики в значительной степени варьировала в зависимости от вида проводимого лечения и в наблюдаемых группах имелись существенные различия показателей достигающие статистической значимости. Как правило, достоверные изменения, у пациентов, получавших комбинированную терапию, регистрировались уже на 15- 30 сутки проводимого лечения, в то время, как у наблюдаемых, получивших в качестве лечебного метода только психотерапию, лишь на 60 сутки. Так изучаемые параметры по шкале HADS у больных группы В уже на 15 сутки достоверно изменились. По подшкале депрессия статистическая значимость составила (р<0,01), по подшкале тревога (р<0,05). Уже на тридцатые сутки проводимого лечения достоверность улучшения показателя достигла величины (р<0,001). В то время как у пациентов группы С на протяжении всего наблюдения отмечалась тенденция к улучшению показателя достигшая статистической значимости лишь в исходе и не вышедшая за пределы значения (р<0,05). Аналогичная картина ярко демонстрировшая преимущество комбинированной терапии с применением селективных серотонинпозитивных антидепрессантов наблюдалось по всем остальным использованным опросникам. Так у больных группы В по шкалам HDRS и MADRS через 4 недели лечения изучаемые параметры, достигнув значений 12,9±0,5 и 25,8±0,9 соответственно, улучшались достоверно (p<0,05). Уже через 2 месяца проводимой терапии, те же показатели имели результаты 6,1±0,4 и 12,3±0,7. Статистическая значимость изменений по сравнению с первым днем наблюдений составляла (p<0,001). У пациентов группы С те же методики зарегистрировали достоверное улучшение показателей лишь на 60 сутки (p<0,05).
Причем достигнутые значения 12,2±0,8 и 24,8±0,8 статистически отличались (p<0,001) от аналогичных значений, полученных в исходе у сравниваемой группы. По шкале SDS применение фармакопрепаратов позволило отметить достоверные изменения (p<0,05) на 15 сутки лечения, в то время как статистически значимые изменения при использовании в качестве лечебного агента только психотерапии произошли на последних этапах наблюдения. Полученные данные отражены в таблице 4.
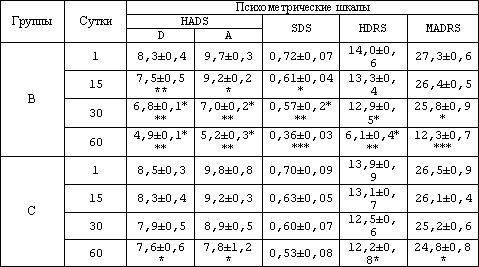
Таблица 4. Динамика редукции депрессивной симптоматики в зависимости от вида тимоаналептической терапии
Результаты проведенных исследований убедительно продемонстрировали, что общее восприятие человеком своего здоровья, качество жизни имеет достоверно большую позитивную направленность у здоровых наблюдаемых по сравнению с больными СБД ВНЧС. И это не удивительно, ведь выраженные болевые ощущения, сопровождающие данное заболевание, помимо вполне понятного психологического повышения тревожности и ухудшения восприятия состояния здоровья, снижения активности, могут на биохимическом и биофизическом уровне опосредованно влиять на показатели качества жизни. Изменяя, например, активность элементов лимбической системы, количество и соотношение некоторых нейромедиаторов и нейропептидов в центральной нервной системе. Подобные нарушения способны в значительной степени влиять на аффективную симптоматику, являющуюся: либо негативным фоном, ухудшающим показатели качества жизни, либо психосоматической детерминантой, определяющей всю направленность патологического процесса.
На личностном уровне боль и страдание воспринимаются вместе (единым образом), как контрастные понятию радости и удовольствия. Поэтому боль почти всегда ассоциируется с таким кардинальным симптомом депрессии как ангедония, т.е. неспособность получать радость, удовольствие. Практически у всех больных с хронической болью отмечаются те или иные аффективные нарушения и прежде всего тревожная и депрессивная симптоматика, которые одновременно являются причиной или следствием боли. По литературным данным от 30% до 50% больных с хроническими болевыми синдромами страдают психическими расстройствами. Причем 2/3 из них отвечают диагностическим критериям большого депрессивного эпизода. В большинстве случаев депрессия развивается вторично, т.е. после появления болевого синдрома. [5] У данных больных выявлено пониженное содержание 5-оксиндолуксусной кислоты (5-ОИУК), основного метаболита серотонина. Было установлено также, что у депрессивных пациентов с выраженной болевой симптоматикой наблюдается более низкая активность тромбоцитарной МАО, которая, как известно, положительно коррелирует с концентрацией в ликворе 5-ОИУК. [8] Таким образом, не исключено, что общее патогенетическое звено, связывающее депрессии и болевую симптоматику, может состоять именно в недостаточности серотонинергической системы. Эта гипотеза отчасти подтверждается также высокой эффективностью при болевых синдромах серотонинергических антидепрессантов. Все перечисленные данные свидетельствуют о сложном и пока недостаточно ясном патогенезе хронического болевого синдрома, в механизмах которого, по крайней мере у части больных, несомненно принимает участие депрессия, что уже оправдывает применение тимоаналептической терапии. По видимому, болевая и депрессивная симптоматика взаимодействуют по типу "порочного круга", осложняя и питая друг друга. [5;6]
Проведенные исследования однозначно свидетельствовали о преимуществах комбинированной антидепрессивной терапии, с применением серотониновых антидепрессантов. По-видимому, именно применение последних позволило добиться статистически значимых изменений уже на 2 неделе проводимого лечения депрессии. У многих антидепрессантов выраженный гипотимический эффект наблюдается не ранее чем через 3 недели непрерывной терапии, в то время как селективные ингибиторы реаптейка серотонина часто в более сжатые сроки проявляют свое тимоаналептическое действие. [2] Необходимо отметить несколько более быстрое достижение достоверных позитивных результатов, определяемое по шкалам HADS и SDS. Последние являются так называемыми субъективными опросниками в противовес двум примененным другим объективным клиническим рейтинговым шкалам. Каждый из этих инструментов имеет свои ограничения: использование объективных шкал требует участия квалифицированного специалиста или предварительного обучения исследователя; при применении субъективных шкал возможно возникновение артефактов заполнения. Считается, что для детальной формализованной оценки состояния на момент обследования и в динамике предпочтительнее более чувствительные объективные методики. Следует отметить, что антидепрессанты являются достаточно эффективным средством купирования хронической боли самого различного происхождения и обладают не только собственно аналгезирующим действием, но и значительно уменьшают сопровождающую ее эмоциональную (аффективную) реакцию, т.е. облегчают переживание боли и страдания больного. Ведь вслед за уменьшением боли обычно появляется и отчетливое психотропное действие – улучшается настроение, повышается работоспособность, восстанавливаются интересы, исчезает фобическая симптоматика (тревожное ожидание боли). Меняется само восприятие боли и отношение к ней, оно становится более рациональным, устраняется ее аффективная насыщенность. Происходит постепенное дистанцирование личности от болевых ощущений, что позволяет активизировать ее защитные механизмы и адаптационные возможности. Антиноциптивные свойства у тимоаналептиков были обнаружены почти сразу же после их введения в психиатрическую практику. За 40-летнюю историю их применения было выполнено огромное количество открытых и контролированных исследований, подтверждающих их эффективность при хронических, органических болевых синдромах различной этиологии, в том числе и резистенцитных к применению обычных аналгизирующих средств. Теоретически антидепрессанты могут оказывать антиноциптивный эффект по трем основным механизмам: редуцируя депрессию, потенцируя действие экзогенных или эндогенных аналгизирующих веществ, в силу собственных аналгизирующих свойств. Последний факт подтверждается данными, полученными при экспериментальном изучении у животных и у человека, свидетельствующими, что антидепрессанты увеличивают порог болевой чувствительности и оказывают антиноцептивный эффект, связанный с прямым воздействием на опиатные рецепторы. Вместе с тем, остается неясным, происходит ли стимуляция опиатных рецепторов первично или опосредованно, через активацию норадренергических и серотонинергических нейронов. Современные теории эндогенного контроля боли, предполагают вовлеченность в этот процесс обеих нейромедиаторных систем, хотя в последние годы акцент делается на недостаточности серотонинергической системы. [5] Последнее может служить теоретическим обоснованием полученных нами клинических результатов, свидетельствующих о высокой эффективности серотонинпозитивных антидепрессантов, не только в терапии гипотимии при СБД ВНЧС, но и в нивелировании выраженной болевой симптоматики и как следствие этого повышения качества жизни больных.
Синдром болевой дисфункции ВНЧС сопровождается выраженным снижением качества жизни. Применение антидепрессантов, в частности селективных ингибиторов реаптейка серотонина у больных СБД ВНЧС с депрессивными проявлениями способствует достоверно более быстрому нивелированию гипотимических симптомов и повышению качества жизни больных.